Chimie générale
Wikipedia a des informations liées à des précipitations (chimie)
Une réaction de précipitation se produit lorsqu'une substance ionique sort de la solution et forme un solide insoluble (ou légèrement soluble). Le solide qui sort de la solution est appelée un précipité. Cela peut se produire lorsque deux sels solubles (composés ioniques) sont mélangées et forment une seule le précipité insoluble.
Un exemple est le nitrate de plomb mélangé avec de l'iodure de potassium, ce qui forme un précipité jaune vif de l'iodure de plomb.
Notez que l'iodure de plomb est formé comme un solide. L'équation précédente est écrit sous forme moléculaire, ce qui est la meilleure façon de décrire la réaction. Chacun des éléments existent réellement dans la solution sous forme d'ions individuels, non liées les unes aux autres (comme dans les cristaux d'iodure de potassium). Si nous écrivons ci-dessus comme une équation ionique. nous obtenons une bien meilleure idée de ce qui se passe réellement.
Notez les termes tels que des deux côtés de l'équation. Ceux-ci sont appelés ions spectateurs parce qu'ils ne participent pas à la réaction. Ils peuvent être ignorés, et l'équation ionique nette est écrite.
Dans la solution, il existe à la fois le plomb et les ions iodure. Parce que l'iodure de plomb est insoluble, ils cristallisent spontanément et forment le précipité.
Acid-Base Neutralisation Modifier
En termes simples, un acide est une substance qui peut perdre un ion H + (à savoir un proton) et une base est une substance qui peut accepter un proton. Lorsque des quantités égales d'un acide et la base réagissent, ils se neutralisent mutuellement, formant des espèces qui ne sont pas comme acide ou basique.
Par exemple, lorsque l'acide chlorhydrique et l'hydroxyde de sodium réagissent, ils forment l'eau et du chlorure de sodium (sel de table).
Encore une fois, nous obtenons une image plus claire de ce qui se passe si nous écrivons une équation ionique nette.
Les réactions de base acides se produisent souvent en solution aqueuse, mais ils peuvent également se produire à l'état gazeux. Les acides et les bases seront discutées beaucoup plus en détail dans la section des acides et des bases. la réaction
La combustion du méthane (libérant de la chaleur et de la lumière)
Combustion, mieux connu comme la combustion, est la combinaison d'une substance avec de l'oxygène. Les produits sont le dioxyde de carbone, l'eau, et éventuellement d'autres déchets. Les réactions de combustion libèrent de grandes quantités de chaleur. C3 H8. mieux connu sous le propane, subit une combustion. L'équation est équilibrée:
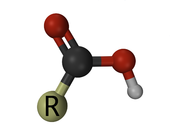
C'est un acide carboxylique. Tous les groupes fonctionnels se terminent par un « R » -a espace réservé pour le reste de la molécule.
se produisent des réactions organiques entre les molécules organiques (contenant des molécules de carbone et d'hydrogène). Comme il y a un nombre pratiquement illimité de molécules organiques, la portée des réactions organiques est très grande. Cependant, un grand nombre des caractéristiques des molécules organiques sont déterminés par les groupes de groupes fonctionnels d'atomes qui réagissent de manière prévisible.
Un autre concept clé dans les réactions biologiques est basicité de Lewis. Des parties de molécules organiques peuvent être électrophile (électron-aimant) ou nucléophile (noyau, ou positif aimant). régions nucléophile ont un excès d'électrons, ils agissent comme bases de Lewis, alors que les zones-électrophile sont déficientes en électrons et agissent comme des acides de Lewis. Les régions et électrophile attirent nucléophile et réagissent les uns avec les autres. Les réactions organiques sont au-delà de la portée de ce livre, et sont traités plus en détail dans la chimie organique. Cependant, la plupart des substances organiques peuvent subir des réactions de remplacement et les réactions de combustion, comme vous l'avez déjà appris.
La formation de fluorure d'hydrogène à partir des éléments nécessite une réduction du fluor et de l'oxydation de l'hydrogène.
Redox est une abréviation de réactions de réduction / oxydation. C'est exactement ce qui se passe dans une réaction d'oxydo-réduction, une espèce est réduite et un autre est oxydé. Réduction implique un gain d'électrons et à l'oxydation implique une perte, de sorte qu'une réaction d'oxydoréduction est celui dans lequel les électrons sont transférés entre les espèces. Les réactions où quelque chose est « brûlé » (moyens de combustion étant oxydées) sont des exemples de réactions redox, cependant, des réactions d'oxydation se produisent également en solution, ce qui est très utile et constitue la base de l'électrochimie.
Les réactions d'oxydoréduction sont souvent écrites en deux demi-réactions montrant la réduction et les processus d'oxydation séparément. Ces demi-réactions sont équilibrées (en multipliant chaque coefficient par un) et ajoutés ensemble afin de former l'équation complète. Lorsque le magnésium est brûlé dans l'oxygène, il perd des électrons (il est oxydé). A l'inverse, les gains en oxygène électrons du magnésium (il est réduit).
Les réactions d'oxydoréduction seront discutés plus en détail dans la section d'oxydo-réduction.