Les demi-vies
Nous utilisons des lois de taux intégrés, et les constantes de vitesse pour relier les concentrations et le temps. La loi du taux d'utilisation dépend de l'ordre global de la réaction.
Les équations pour Half Lives
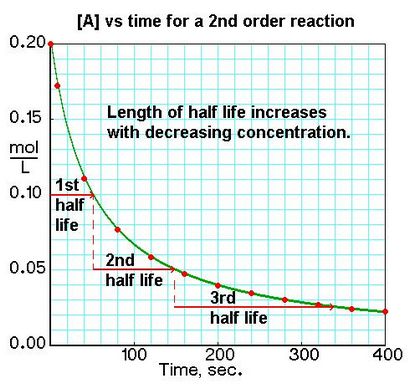
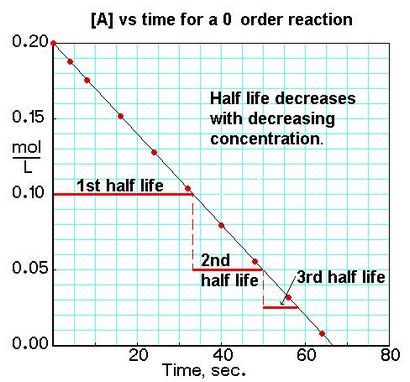
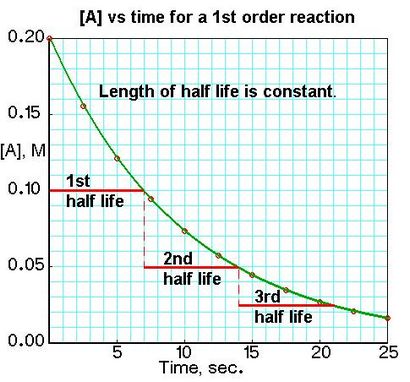
Pour un produit reactionA de commande zéro. vitesse = k: t½ = [Ao] / 2k pour une première réaction commander des produits A. vitesse = k [A]: t½ = 0,693 / k pour un produit seconde réaction afin 2A ou A + B produits (lorsque [A] = [B]), prix = k [A] 2: t½ = 1 / k [Ao ]
Déterminer une demi-vie
Pour déterminer une demi-vie, t½. le temps nécessaire à la concentration initiale d'un réactif à réduire à la moitié de sa valeur initiale, nous avons besoin de savoir:
- L'ordre de la réaction ou suffisamment d'informations pour déterminer.
- La constante de vitesse, k, pour la réaction ou suffisamment d'informations pour déterminer.
- Dans certains cas, nous avons besoin de connaître la concentration initiale, [Ao]
Remplacez ces informations dans l'équation de la demi-vie d'une réaction avec cet ordre et résoudre pour t½. Les équations sont données ci-dessus.
La conversion d'une demi-vie à un taux constant
Pour convertir une demi-vie à une constante de vitesse, nous devons savoir:
- La demi-vie de la réaction, t½.
- L'ordre de la réaction ou suffisamment d'informations pour déterminer.
- Dans certains cas, nous avons besoin de connaître la concentration initiale, [Ao]
Remplacez ces informations dans l'équation de la demi-vie d'une réaction avec cet ordre et résoudre pour k. Les équations sont données ci-dessus.
Relations avec les graphiques et les demi-vies
Si nous traçons la concentration d'un réactif en fonction du temps, nous pouvons voir les différences dans les demi-vies pour les réactions de différents ordres dans les graphiques. Nous pouvons identifier 0, 1 er. ou 2 e réaction de l'ordre d'un tracé de [A] par rapport à t par la variation dans le temps de la concentration d'un réactif à changement de moitié.
Pour un produit reactionA de commande zéro. vitesse = k:
Pour une première réaction commander des produits A. vitesse = k [A]:
Pour une seconde réaction afin de produits 2a ou A + B (produits lorsque [A] = [B]), prix = k [A] 2: