Rouge rubis, Causes de couleur


rouge rubis. Le rubis nom vient du latin « rubrum », qui signifie rouge. Le rubis, ainsi que le saphir, est dans le groupe de corindon. Rubis sont faits de corindon de chrome présent comme impureté. Les plus brillants rouges - et donc le plus précieux - rubis sont généralement de la Birmanie. rubis rouge foncé et violet proviennent principalement de la Thaïlande. De petites quantités de rubis se trouvent également au Sri Lanka, le Cambodge, le Pakistan, l'Inde et la Tanzanie. Rubies ont longtemps été chéri parmi les gemmes les plus belles et précieuses du monde. Le minéral le plus dur après le diamant, la friabilité du rubis nécessite des soins lors de la coupe.
Pourquoi sont rouges de rubis?
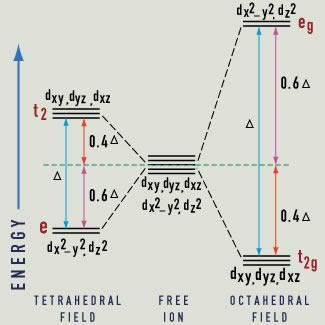
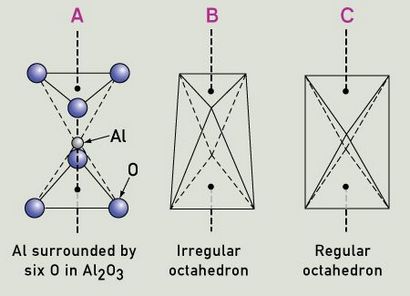
Les trois atomes d'oxygène au-dessus de l'aluminium sont plus proches les uns des autres que les trois atomes d'oxygène ci-dessous, et l'atome d'aluminium est un peu inférieur à mi-chemin vers le bas. La moitié des atomes d'aluminium ont cet agencement, et l'autre moitié ont une disposition inversée. Si cette disposition est considérée en termes de liaisons ioniques, l'ion d'aluminium positif est entouré par six charges négatives (ions d'oxygène). Chaque atome d'aluminium fait un don de trois électrons pour devenir Al 3+ et n'a pas le niveau d'énergie inoccupés, alors que chaque atome d'oxygène reçoit deux électrons, assurant qu'il n'a pas le niveau d'énergie inoccupés. Par conséquent, deux atomes d'aluminium donate un total de six électrons, et trois atomes d'oxygène reçoivent un total de six électrons, pour produire Al2 O3. Ils produisent un champ électrostatique autour des ions d'aluminium, appelé champ cristallin. Étant donné que la liaison ne soit pas purement ionique, mais a une certaine nature covalente, il peut également être traité comme un champ de ligand. Ainsi, non seulement les charges électriques, mais aussi les caractéristiques de liaison spécifiques des ligands (des ions ou des molécules autour de l'atome central ou ion) sont inclus. La symétrie et la force du champ de ligand doivent être considérés à la fois pour prédire les effets des ligands.
En corindon pur, tous les électrons sont appairés et il n'y a pas d'absorption de la lumière. Une fois que l'un sur cent des atomes d'aluminium sont remplacés par des atomes de chrome, chargé négativement ions oxygène entourent l'ion d'aluminium (qui a donné 3 électrons), de sorte qu'un atome de chrome doit donner de trois électrons pour devenir Cr 3+. remplaçant Al 3+. pour que la charge reste la même. Dans Al 3+, il n'y a pas de niveaux d'énergie partiellement remplis ou orbitals. Cependant, en Cr 3+ il y a partiellement rempli niveaux d'énergie ou orbitals. Ce sont ces électrons qui peuvent être excités et que l'absorption de certaines longueurs d'onde de la cause de la lumière, ce qui entraîne en couleur.
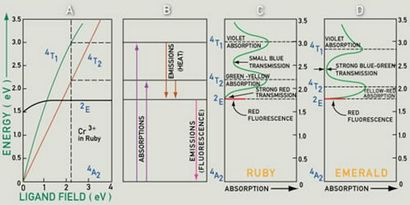
Lumière sous la forme d'un photon peut être absorbé si l'énergie du photon correspond exactement à l'énergie nécessaire à un électron pour « sauter » à un niveau d'énergie plus élevé. Pour l'énergie à conserver, l'énergie des photons doit correspondre à l'énergie « saut », qui est la différence d'énergie entre l'état final et l'état initial de l'électron.