Calcul Définition et formule de charge formelle - Vidéo & Transcript Leçon
Il est important de savoir ce que la contribution des électrons de valence est de chaque atome dans une molécule. Pour déterminer cela, on calcule la charge formelle des atomes. Dans cette leçon, nous allons discuter de la façon de déterminer la charge formelle.
Qu'est-ce que charge formelle?
Nous pouvons déterminer ce que la distribution d'électrons dans une molécule est en déterminer la charge formelle. La charge formelle est la charge d'un atome dans une molécule. En ajoutant toutes les charges formelles de tous les atomes dans la molécule, vous pouvez déterminer si la charge globale de la molécule est positive, négative ou neutre. La façon de déterminer la charge formelle est à l'aide de l'équation suivante:

Structure Lewis
Pour visualiser ce que dit la formule, nous allons d'abord examiner la structure de Lewis. qui est un dessin de la molécule qui montre toutes les liaisons et les électrons non liants. Jetons un coup d'œil à l'exemple du dioxyde de carbone Lewis structure représentée ici (voir la vidéo). La structure de Lewis de dioxyde de carbone montre que, lorsque nous disons que les électrons de liaison. nous avons besoin de compter les lignes sur la structure. Une ligne correspond à deux électrons. Les électrons non liantes. d'autre part, sont les électrons non partagés. Ceux-ci sont présentés sous forme de points. Un point est égal à un électron non liante. Les électrons de valence sont les électrons sur l'enveloppe la plus extérieure de l'atome.
Électrons de valence
Rappelons une façon simple de compter les électrons de valence en fonction de leur numéro de groupe dans le tableau périodique. Il existe un modèle pour compter les électrons de valence sur la base du numéro de groupe d'un atome a. Par exemple, le sodium (Na) est dans le groupe 1, par conséquent, il a 1 électron de valence. L'oxygène (O) est dans le groupe de 16, donc elle a 6 électrons de valence. Du brome (Br) est dans le groupe 17, de sorte qu'il a 7 électrons de valence. Une exception que nous devons prendre note est à l'hélium (He). Il est dans le groupe 18; cependant, il ne dispose que de deux électrons de valence, car le nombre maximum d'électrons est égal à 2. Tous les autres gaz nobles du groupe 18, tel que le néon (Ne), l'argon (Ar), et le reste, avoir 8 électrons de valence. Nous sommes partis des groupes 3-12. En effet, aucun modèle existe pour les électrons de valence pour ces éléments, et il y a une façon différente et plus complexe de compter leurs électrons de valence.
Step-by-Step Method
Maintenant que nous connaissons la formule pour déterminer la charge formelle, nous allons mettre cela en pratique et aller sur la façon de déterminer la charge formelle pour chaque atome dans une étape molécule par étape. La formule de la charge formelle est:
Commençons par quelque chose de simple, comme le dioxyde de carbone. Le dioxyde de carbone a un atome de carbone et deux atomes d'oxygène. Sa structure de Lewis ressemble à ceci:
Etape 1: Calculer la charge formelle de C
Carbone (C) est dans le groupe 14, ce qui signifie qu'il a 4 électrons de valence. Il n'y a pas de points autour de carbone, ce qui signifie qu'il n'a pas d'électrons non liantes. Il y a 4 lignes autour de carbone, et une ligne est égale à deux électrons de liaison. Carbon, par conséquent, possède 8 électrons de liaison.
4 est égal à la Victoire en Europe
N'est égal à 0
BE est égal à 8
Remplaçons maintenant les valeurs, et nous avons:
charge formelle = 4 - 0 - 0 = 8/2
La charge formelle de carbone est 0.
Étape 2: Calculer la charge formelle de l'oxygène sur la gauche
L'oxygène (O) est dans le groupe 16, ce qui signifie qu'il a 6 électrons de valence. Il y a 4 points autour de l'oxygène, ce qui signifie qu'il a 4 électrons non liantes Il y a 2 lignes attachées à l'oxygène, et une ligne est égale à deux électrons de liaison. L'oxygène, par conséquent, a 4 électrons de liaison.
6 est égal à la Victoire en Europe
N'est égal à 4
BE est égal à 4
Remplaçons maintenant les valeurs, et nous avons:
charge formelle = 6 - 4 - 4/2 = 0
La charge formelle d'oxygène (à gauche) est 0.
Étape 3: Calculer la charge formelle de l'oxygène sur le droit
L'oxygène (O) est dans le groupe 16, ce qui signifie qu'il a 6 électrons de valence. Il y a 4 points autour de l'oxygène, ce qui signifie qu'il a 4 électrons non liantes. Il y a 2 lignes attachées à l'oxygène, et une ligne est égale à deux électrons de liaison. L'oxygène, par conséquent, a 4 électrons de liaison.
6 est égal à la Victoire en Europe
N'est égal à 4
BE est égal à 4
Remplaçons maintenant les valeurs, et nous avons:
La charge formelle d'oxygène (à droite) est égal à 0.
Étape 4: Vérifier la charge globale
déverrouiller contenu
Plus de 55 000 leçons dans tous les sujets majeurs
Accès GRATUIT pour 5 jours,
il suffit de créer un compte.
Aucune obligation, annuler à tout moment.
Sélectionnez un sujet à des cours liés à l'aperçu:
Maintenant, nous ajoutons toutes les charges formelles des atomes dans la molécule de dioxyde de carbone. Le fait que le dioxyde de carbone n'a pas de superscript qui se rapporte à charger, signifie que la charge globale doit être égale à zéro. double vérification Let (voir la vidéo). Toutes les charges formelles sont nuls. Si nous les ajoutons tout, la somme sera égale à zéro. Nous savons que le dioxyde de carbone est une molécule neutre, ce qui signifie que sa charge globale est égale à zéro. Nous venons de confirmer cela en calculant toutes les charges formelles ensemble et obtenir une somme qui est égale à zéro. Les valeurs sont d'accord, ce qui signifie que nous l'avons fait correctement.
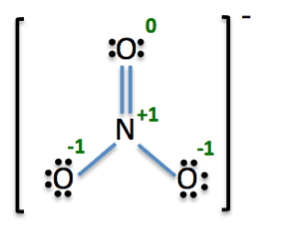
Prenons un autre exemple. Regardons l'ion nitrate chargé négativement. Le signe négatif sur le côté supérieur droit de la structure de Lewis signifie que sa charge globale est -1 (voir vidéo). Trouvons les charges formelles de l'azote et les trois atomes d'oxygène. Nous allons étiqueter chaque oxygène avec un nombre en rouge (voir la vidéo). Maintenant, nous pouvons calculer les charges formelles pour tous les atomes dans la molécule de nitrate:
Azote:
L'azote (N) est dans le groupe 15, de sorte qu'il a 5 électrons de valence (VE). Il y a quatre lignes autour de lui, il a 8 électrons de liaison (BE), et il n'y a pas de points autour d'elle, donc il n'y a pas d'électrons non liantes (NE).
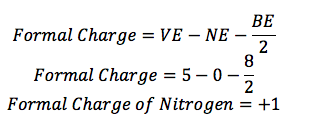
Oxygène 1:
L'oxygène (O) est dans le groupe 16, de sorte qu'il possède 6 électrons de valence (VE). Il y a 2 lignes qui lui sont attachés, de sorte qu'il dispose de 4 électrons de liaison (BE), et il y a 4 points autour de lui, de sorte qu'il y a 4 électrons non liantes (NE).
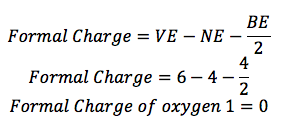
Oxygène 2:
L'oxygène (O) est dans le groupe 16, de sorte qu'il possède 6 électrons de valence (VE). Il est une ligne attachée à elle, de sorte qu'il a 2 électrons de liaison (BE), et il y a 6 points autour de lui, alors il y a 6 électrons non liantes (NE).
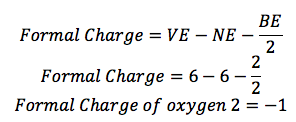
Oxygen 3:
L'oxygène (O) est dans le groupe 16, de sorte qu'il possède 6 électrons de valence (VE). Il est une ligne attachée à elle, de sorte qu'il a 2 électrons de liaison (BE), et il y a 6 points autour de lui, alors il y a 6 électrons non liantes (NE).
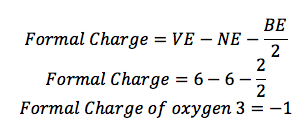
Charge globale:
Maintenant, nous ajoutons tous les frais formels:
La charge globale est égale à -1. Ceci est en accord avec la charge globale correcte des ions nitrate. Cela nous donne une bonne indication si nos calculs sont corrects.
Revoyons. La charge formelle calcule la charge individuelle d'un atome dans une molécule. Indique si l'atome a ou non une charge positive, négative ou neutre. La charge formelle est déterminée par les électrons de valence (VE), des électrons non liantes (NE), et des électrons de liaison (BE) dans la formule suivante:
En calculant la charge formelle de chaque atome dans une molécule, nous pouvons déterminer la charge globale de la molécule.
Collège de crédit Gagner
Saviez-vous que ... Nous avons plus de 95 cours de niveau collégial que vous vous préparez à gagner le crédit par l'examen qui est acceptée par plus de 2000 collèges et universités. Vous pouvez tester des deux premières années de collège et de sauver des milliers de votre diplôme. Tout le monde peut gagner des crédits par examen quel que soit l'âge ou le niveau d'éducation.
Transfert de crédit à l'école de votre choix
Je ne sais pas ce que l'université vous voulez assister encore? Study.com a des milliers d'articles sur tous les degrés imaginables, domaine d'études et de carrière qui peut vous aider à trouver l'école qui est bon pour vous.
Écoles de recherche, grades - Carrières
Obtenez les informations impartiales vous devez trouver la bonne école.