Chimie Notation orbitale et Lewis Dot - Shmoop Chemistry
Puisque nous sommes des experts à déterminer la configuration électronique, explorons une autre notation appelée notation orbitale. Dans un sens, la notation orbitale est très similaire à la façon que nous avons apprises pour représenter les configurations d'électrons dans la section précédente. À vrai dire, il est juste une autre méthode pour dessiner la configuration de manière à identifier facilement la façon dont l'élément peut se lier à d'autres éléments.
La notation orbitale nous aide également à comprendre ce qui se passe réellement à l'intérieur de tous ces fous orbitals. Par exemple, quand on voit la configuration électronique « 3p 5, » nous savons qu'il ya 5 électrons dans le p sous-shell, mais nous ne savons pas qui ORBITALS les électrons sont effectivement situés. Ne vous inquiétez pas, la notation orbitale nous donne avec ce niveau de détail qui ne peut simplement pas être trouvée dans la configuration électronique.
Commençons. D'abord, nous devons faire la configuration électronique d'un atome. Vous voulez utiliser du silicium comme un exemple? Nous l'espérons.
problème échantillon
Silicium
1s 2 2s 2 2p 6 3s 2 3p 2
Le rappel de premier let:
• Les sous-couches de 1 orbitale ont
• p ont 3 sous-couches orbitals
• d 5 ont sous-couches orbitals
• f sous-couches ont 7 orbitales
Ensuite, nous allons remplir les électrons représentés sous forme de flèches. Ne pas oublier la règle de Hund lors du remplissage de vos électrons. Rappelez-vous que la solution la plus stable pour les électrons dans chaque sous-shell est celui avec le plus grand nombre de tours parallèles, nous allons distribuer des électrons uniformément avec une première orbitals donnée avant toute sous-shell appariement se produit. En d'autres termes, chaque cercle devient une flèche avant que le cercle reçoit deux flèches.
Il existe deux autres façons que nous pourrions voir la notation orbitale représentée:
2) Lorsque les orbitales sont représentées par des cercles et les électrons sont représentés par des barres obliques.
Lewis Dot Notation
Il y a une autre notation spéciale et commune dans la chimie que nous maîtrisera: Lewis Dot Notation.
Maintenant, la présentation, en direct de Berkley, Californie: Lewis et ses points étonnants. la notation de points Lewis a été présenté par Gilbert Newton Lewis en 1916 dans un article intitulé « L'atome et la molécule » publié dans le Journal of American Chemical Society.

Cela va paraître simple. C'est parce qu'il est simple; grâce à ce bon vieux Gilbert. Lewis a été la première personne que nous savons avoir fait cela et de le rendre si évidemment simple pour le reste d'entre nous. Bon travail, Lewis.
Cette notation est juste une autre façon de montrer des détails sur la valence coquille (externe) d'un atome. Contrairement à la configuration d'électrons, qui comprend tous les électrons d'un atome a à offrir, des points de Lewis ne concernent que des électrons dans l'enveloppe extérieure plus d'un atome. Cela signifie que peu importe combien d'électrons un élément contient, points de Lewis ne sera jamais plus grand nombre de huit. Si elle aide, rappelez-vous cette émission TV super hip de 1977 Huit, ça suffit.
Revenons au silicium comme exemple. Nous avons déjà appris la configuration électronique du silicium est 1s 2 2s 2 2p 6 3s 2 3p 2. Le premier (n = 1) et deuxième (n = 2) Les réservoirs sont complètement remplis. Le troisième (n = 3) a une enveloppe remplie orbitale s mais il est p et orbitales d restent vides. Par conséquent, la troisième coquille est notre coquille de valence et les électrons dans cette enveloppe sont les électrons de valence.
La notation dot Lewis est constituée du noyau (le noyau et l'ensemble de ses électrons internes qui est représentée par le symbole élémentaire) et les électrons de valence représentés par des points. Consultez la structure de points lewis de carbone ci-dessous:
La lettre « C » est le noyau, et comme nous l'avons dit cela représente l'atome et ses électrons de la couche interne (les 1 2 électrons). Les quatre électrons de valence restants sont placés autour du noyau selon des règles spécifiques. Ne vous inquiétez pas les règles pour l'instant. Nous les aurons bientôt. Chacun des quatre côtés autour du symbole élémentaire représente une des orbitales dans l'enveloppe extérieure. Voici les règles:
Règle 1. Aucun effet secondaire peut avoir plus de deux points parce que chaque orbitale ne peut contenir que deux électrons.
Règle n ° 2. Lors du remplissage des côtés du symbole de l'élément de chaque côté obtient un point avant de doubler ... qui est la règle de Hund, pas la nôtre. Les exceptions à cette règle sont l'hydrogène et l'hélium depuis leur coquille extérieure ne peuvent contenir que deux électrons. Tout autre élément obéit à la seconde règle.
Combien de points doit-on placer autour de chaque élément? La réponse est étonnamment simple. Il suffit de jeter un oeil à la table périodique ci-dessous. Rappelez-vous comment chaque point est censé représenter le nombre d'électrons dans les éléments de coque extérieure? Eh bien, le tableau périodique affiche les éléments d'une manière pour nous de déterminer facilement combien d'électrons sont dans leur enveloppe extérieure.
La colonne dans laquelle se trouve l'élément nous dira combien de électrons de valence chaque élément a dans son enveloppe extérieure. Rappelez-vous l'hydrogène et l'hélium ne peut avoir un maximum de 2 électrons de valence dans leur enveloppe extérieure de sorte qu'ils sont les exceptions à la règle.
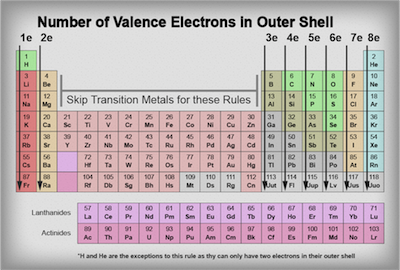
Voyons quelques exemples:
Gardez à l'esprit peu importe où nous avons mis notre point autour de l'élément. Assurez-vous de choisir un côté, puis commencer à ajouter vos points dans les deux sens horaire ou anti-horaire de manière autour de l'élément. Dans l'exemple ci-dessus, nous avons choisi de commencer sur le côté droit de l'élément et ensuite autour de l'élément de remplissage en points dans le sens des aiguilles d'une montre.
S'il vous plaît se référer à cette vidéo pour un tutoriel sur la façon de « point » vos éléments correctement.
Déplacement sur l'élaboration de structures de points de Lewis de divers composés:
Étape 1. Compter le nombre total d'électrons de valence dans le composé. Utilisez le tableau périodique pour déterminer combien de électrons de valence chaque élément individuel du composé Contribue les ajouter ensuite tout. Prenez H2 O par exemple. Chaque atome d'hydrogène contribue 2 électrons de valence et de l'atome d'oxygène contribue 6 ... pour un total de 8 électrons de valence.
Étape 2. Si nous avons affaire à un ion polyatomique avec une charge négative (CO3 2-), ajoutez les électrons nécessaires à l'étape 1 pour tenir compte de la charge. Pour (CO3 2-), nous ajoutons deux autres électrons ou des points parce que chaque électron est égale à une unité de charge négative. En variante, si l'ion polyatomique a une charge positive (NH4 +), soustraire les électrons nécessaires à l'étape 1 pour tenir compte de la charge positive. Pour (NH4 +), nous soustraire un électron.
Étape 3. Dessiner la structure du squelette de la molécule en plaçant une ligne (représentant deux électrons partagés) entre chaque paire d'atomes liés. Exemple: H-Cl.
Si la molécule contient plus de 2 atomes au moins un atome électronégatif sera habituellement dans la position centrale. En général, électronégativité augmente de gauche à droite sur le tableau périodique (à l'exception des gaz nobles ... ils sont parfaits juste la façon dont ils sont). Par exemple, le carbone est moins électronégatif que l'oxygène. Pour le (CO3 2-) molécule, le carbone serait l'atome central. Ci-dessous, il y a des exemples à voir dans le cas où le visuel aidera.
Étape 4. Ensuite arranger les atomes de telle sorte où les atomes environnants ont chacun une enveloppe extérieure complète d'électrons.
Étape 5. ajouter Enfin, les électrons restant à l'atome central.
En plongeon olympique, les plongeurs espèrent un parfait 10. Avec les enveloppes extérieures des électrons de valence, le score parfait est de 8.
Dessin des structures de points de Lewis est facile, une fois que vous avez pratiqué.
problème échantillon
Tracer la formule structurelle Lewis pour CH4 O.
Remarque: Rappelez-vous que l'hydrogène et l'hélium ne peut avoir un maximum de 2 électrons dans leur enveloppe extérieure.
Le nombre total d'électrons de valence dans ce composé sera:
Carbone (4 valence e -) + quatre atomes d'hydrogène (4 x 1 valence e -) + oxygène (6 valence e -) = 14 électrons de valence totaux
Le carbone est moins électronégatif que l'oxygène, de sorte que le carbone sera notre atome central. La structure individuelle de point de Lewis pour chaque atome ressemble à ceci:
Si nous suivons nos règles, nous constatons que la seule façon une structure de points Lewis acceptable peut être tirée est que si les actions de carbone des électrons avec 3 des atomes d'hydrogène et l'atome d'oxygène. L'hydrogène restes devra partager une paire d'électrons à l'oxygène.
Mettre le tout ensemble, nous allons arranger chacun des éléments et de leurs points de Lewis autour de l'atome de carbone central:
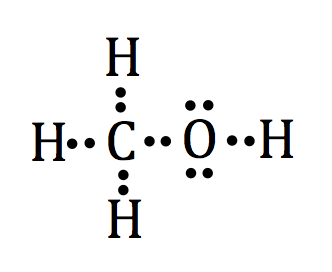
Ou nous utilisons une seule ligne pour représenter une paire de liaison électronique entre les atomes de partage pour ressembler à ceci:
Imaginez les électrons sont toujours là de chaque côté de la ligne (cercle en pointillés), mais maintenant la ligne elle-même représente les électrons partagés. Juste pour être sûr, nous pouvons compter le nombre total d'électrons de valence pour vous assurer qu'il ajoute à la 14 nous avons calculé ci-dessus.
La dernière structure de points Lewis O CH4 ressemblerait à ceci:
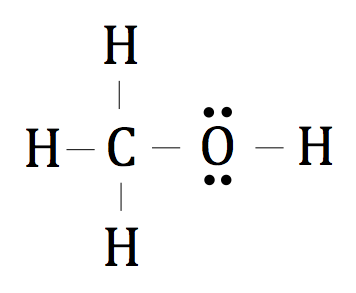
Maintenant, nous allons essayer de dessiner la structure de point d'électrons d'un ion polyatomique, comme CO3 2-.
Ainsi, le nombre total d'électrons de valence dans ce composé sera:
Carbone (4 valence e -) + oxygène trois (3 x 6 valence e -) + 2 e - (supplémentaire pour tenir compte de la charge négative 2) = 24 valence total des électrons
Encore une fois, puisque le carbone est moins électronégatif que l'oxygène, le carbone sera notre atome central, entouré de trois atomes d'oxygène.
Les structures de points lewis de chaque atome individuel sont établis comme suit:
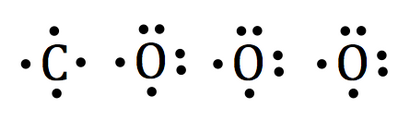
Les trois atomes d'oxygène seront entourent l'atome de carbone.
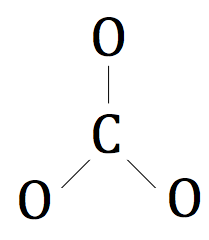
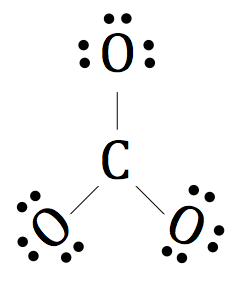
Maintenant, nous allons tirer les électrons de valence restant autour des atomes d'oxygène.
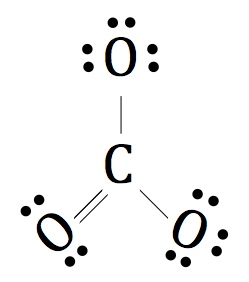
Comme il est un ion polyatomique, nous plaçons un support autour de l'ensemble de la structure et ajouter la charge de deux négatifs à l'extérieur de Lewis Dot complète et finale Notation de CO3 2-.
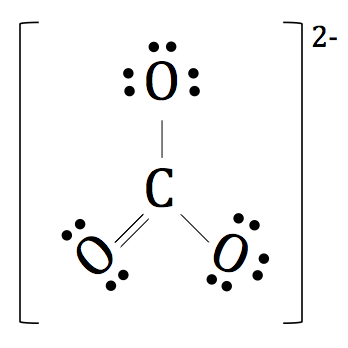
Tout ce discours sur le partage des électrons entre les éléments nous donnent envie de changer votre nom à Bond.