Charge formelle et Lewis Structure
Objectif d'apprentissage
Calculer les frais de forme sur des atomes dans un composé
Points clés
- structures de Lewis. également appelé diagrammes de points de Lewis, la liaison covalente entre les atomes de modèle. Ces schémas utilisent des points autour des atomes pour signifier des électrons et des lignes pour indiquer des liaisons entre les atomes.
- Lewis structures intègrent la charge formelle d'un atome. qui est la charge d'un atome dans une molécule. en supposant que les électrons dans une liaison chimique sont répartis à parts égales entre les atomes.
- Lorsque plusieurs structures de Lewis peuvent représenter le même composé. les différentes formules de Lewis sont appelées structures de résonance.
Une molécule ou un ion polyatomique qui possède plusieurs structures de Lewis parce que la liaison peut être représenté de plusieurs manières.
Atomes perdent, le gain ou partagent des électrons afin d'avoir une coquille pleine de valence de huit électrons.
La charge affectée à un atome dans une molécule, en supposant que les électrons dans une liaison chimique sont répartis à parts égales entre les atomes. Cela permet de déterminer qui de quelques structures de Lewis est la plus correcte.
Structures de Lewis
La structure de Lewis dot de carbone
Une structure typique de Lewis de carbone, avec des électrons de valence désignés sous forme de points autour de l'atome.
Dessin d'une structure de Lewis
Pour dessiner une structure de Lewis, le nombre d'électrons de valence de chaque atome dans le composé doit être déterminée. Le nombre total d'électrons de valence dans l'ensemble du composé est égale à la somme des électrons de valence de chaque atome dans le composé. électrons non valence ne sont pas représentés lors de l'établissement des structures de Lewis.
Par exemple, le CO2 est une molécule neutre avec 16 électrons de valence totale. Dans la structure de Lewis, le carbone doit être doublement lié à deux atomes d'oxygène.
La structure de Lewis pour le dioxyde de carbone
Ce diagramme montre les étapes conceptuelles du dessin de la structure de Lewis pour une molécule de dioxyde de carbone (CO2).
structures de Lewis peuvent également être établies pour les ions. Dans ces cas, la structure entière est placée entre crochets, et la charge est écrit en exposant la partie supérieure droite, à l'extérieur du support.
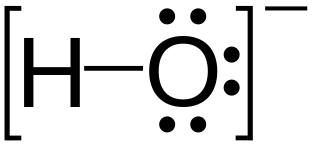
La structure de Lewis pour l'ion hydroxyde
Dans l'ion hydroxyde (OH -), toute la structure est entouré par un support, et la charge est placée à l'extérieur du support.
La détermination de charge formelle
Bien que nous sachions combien d'électrons de valence sont présents dans un composé, il est plus difficile de déterminer autour de laquelle les atomes les électrons résident effectivement. Pour aider à ce problème, les chimistes calculent souvent la charge formelle de chaque atome. La charge formelle est la charge électrique d'un atome aurait si tous les électrons ont été partagés à parts égales.
La charge formelle d'un atome peut être déterminée par la formule suivante:
Dans cette formule, V représente le nombre d'électrons de valence de l'atome dans l'isolement, N est le nombre d'électrons de valence non-liaison, et B est le nombre total d'électrons dans des liaisons covalentes avec d'autres atomes dans la molécule.
Par exemple, nous allons calculer la charge formelle sur un atome d'oxygène dans une molécule de dioxyde de carbone (CO2):
FC = 6 électrons de valence - (4 valence non-liaison des électrons + 4/2 électrons dans des liaisons covalentes)
L'atome d'oxygène en dioxyde de carbone a une charge formelle de 0.
Structures de résonance
structures de résonance
Deux des structures qui contribuent de dioxyde d'azote (NO2). Les deux formules représentent le même nombre d'atomes et d'électrons, juste dans une conformation légèrement différente.