Comment préparer une solution sursaturée
Variable indépendante:
Température
Variable dépendante: degré de cristallisation
variables contrôlées: Type de contenant, la quantité d'acétate de sodium, la quantité d'eau
Il fait froid dehors et vous venez de venir à l'intérieur pour faire du chocolat chaud. Lorsque vous versez le chocolat en poudre dans le lait froid, la poudre se trouve la plupart du temps juste au dessus. Essayez que vous pourriez, vous ne pouvez pas sembler faire la poudre à dissoudre jusqu'à ce que vous chauffez le lait.
Ce processus de dissolution d'un soluté dans une solution est appelée solubilité. et comme vous pouvez le voir dans la fabrication du chocolat chaud, elle est affectée par la température. Si vous souhaitez lire sur la solubilité, consultez cette leçon: Solubilité en chimie: Définition - Propriétés.
Notre objectif sera de déterminer quelle température permet la plus grande solubilité. Si vous pouvez augmenter suffisamment de solubilité, vous pouvez faire une solution sursaturée. une solution qui contient plus soluté que ce qui peut normalement être dissous. Pour ce faire, nous allons créer une solution d'acétate de sodium et de l'eau. Si la solution est sursaturée, la cristallisation se produit, ce qui est le processus de liaison de molécules de soluté dans la solution ensemble. Si nous voyons la cristallisation dans nos échantillons, nous savons que la solution est sursaturée.
Si vous avez besoin de rafraîchir sur les solutions sursaturées d'abord, consultez cette leçon: sursaturée Solution: Définition - Exemple. Avant de commencer, pensez à ce que la température, le froid, la température ambiante ou chaude, créeraient la plus grande solubilité, et donc une solution sursaturée.
- 485 grammes (g) d'acétate de sodium
- Balance pour peser l'acétate de sodium
- 90 millilitres (ml) d'eau
- 3 flacons en verre de 500 ml
- cylindre gradué
- Plaque de cuisson ou d'un poêle
- Réfrigérateur
- Gants
- mitaines de four
- parafilm
- Thermomètre
- Tableau de données:
Température (degrés Celsius)
1. Tout d'abord, l'étiquette d'un flacon « froid », une « température ambiante » et un « chaud ».
2. Mesurer 30 ml d'eau et versez dans le flacon « température ambiante ».
3. Mesurer 30 ml d'eau et versez dans le flacon « froid ». Mettez le flacon au réfrigérateur pour le garder frais.
Conseil de sécurité. Utilisez des gants de cuisine et beaucoup de prudence lorsque des liquides bouillants. Obtenez un adulte pour vous aider.
4. Verser la dernière 30 ml d'eau dans le ballon « chaud ». La chaleur sur le poêle ou une plaque chaude jusqu'à ce qu'elle commence à bouillir. Retirer du feu.
5. Prenez la température de chacun des flacons et enregistrer dans votre tableau de données.
6. Maintenant, versez délicatement 160g d'acétate de sodium dans chaque flacon. Agiter doucement tout en essayant de dissoudre la totalité de l'acétate de sodium.
7. Couvrir chaque flacon avec parafilm et leur permettre d'atteindre la température ambiante.
8. Lorsque tous les flacons sont la même température, soigneusement tomber 1-2 cristaux d'acétate de sodium dans chaque flacon. Surveillez la cristallisation et enregistrer vos observations dans votre tableau de données.
les résultats de la solution sursaturée
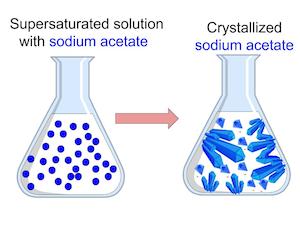
Dépannage
déverrouiller contenu
Plus de 55 000 leçons dans tous les sujets majeurs
Accès GRATUIT pour 5 jours,
il suffit de créer un compte.
Aucune obligation, annuler à tout moment.
Questions de discussion
Quelle solution a été sursaturé? Comment saviez-vous?
Comment la température affecte la solubilité ne?
Comment ça marche
Quand les molécules sont plus chaudes, ils gagnent plus d'énergie thermique à partir de la source de chaleur et commencent à se déplacer plus rapidement. Les molécules se propagent plus éloignées aussi en raison de leur mouvement. Quand les molécules ont froid, ils perdent de l'énergie thermique et se déplacent plus lentement, ce qui les amène également à emballer ensemble. Pour plus d'informations sur la température et le mouvement moléculaire, vous pouvez lire cette leçon: Quelle est la température? - Définition - mesure.
Molécules aller plus vite et se propagent à des températures plus élevées
Lorsqu'une solution est chauffée, comme notre eau et de l'acétate de sodium, les molécules de solvant réparties. Ainsi, nos molécules d'eau chaude ont plus d'espace entre eux que l'eau froide. Comme il n'y a plus d'espace entre les molécules d'eau, il n'y a plus d'espace pour les molécules d'acétate de sodium pour rester dissous. Ainsi, quand une solution est chauffée, elle peut contenir plus de soluté.
solutions Hotter peut contenir plus de soluté
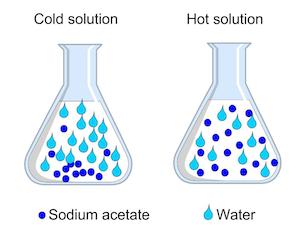
Cela est essentiel pour préparer une solution sursaturée. solutions sursaturées tiennent plus soluté que ce qu'ils pouvaient normalement, comme notre eau chaude. Lorsque la solution refroidit, les molécules de solvant sont de nouveau ensemble, l'éviction de l'acétate de sodium. L'acétate de sodium cherche un endroit où aller. Quand on fait tomber dans les deux cristaux, à la fin, l'excès d'acétate de sodium dans la solution collait à eux, ce qui a provoqué une formation rapide de cristaux. Cristallisation est caractéristique des solutions sursaturées quand ils refroidissent.
Pour déverrouiller cette leçon, vous devez être membre Study.com.
Créez votre compte
Collège de crédit Gagner
Saviez-vous que ... Nous avons plus de 95 cours de niveau collégial que vous vous préparez à gagner le crédit par l'examen qui est acceptée par plus de 2000 collèges et universités. Vous pouvez tester des deux premières années de collège et de sauver des milliers de votre diplôme. Tout le monde peut gagner des crédits par examen quel que soit l'âge ou le niveau d'éducation.
Transfert de crédit à l'école de votre choix
Je ne sais pas ce que l'université vous voulez assister encore? Study.com a des milliers d'articles sur tous les degrés imaginables, domaine d'études et de carrière qui peut vous aider à trouver l'école qui est bon pour vous.
Écoles de recherche, grades - Carrières
Obtenez les informations impartiales vous devez trouver la bonne école.