Configuration électronique - Chimie, socratique
Le Spectroscopie photoélectronique (PSE).
Cette vidéo est sur la Spectroscopie photoélectronique, et discute en détail la génération et l'interprétation des spectres de photoélectrons d'atomes. De plus, dans cette vidéo, je discuterai l'effet photoélectrique et la houe pour calculer l'énergie cinétique des électrons enlevés en utilisant l'énergie de la lumière incidente utilisée et l'énergie de liaison si les électrons. Dans cette vidéo, je discute en détail le photoélectrique spectres des éléments suivants: - sodium, Na - carbone, C - Oxygène, O - Neon, Ne - scandium, Sc De plus, je discute pourquoi 4s orbitale est rempli avant 3d orbitals et pourquoi les électrons sont retirés de 4 s avant 3d. Les étudiants qui étudient la chimie à différents niveaux pourraient fortement bénéficier de cette vidéo.
Questions clés
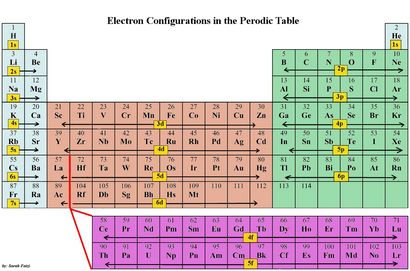
Configurations électronique sont un moyen organisé de documenter la mise en place d'électrons sur la base des groupes et des niveaux d'énergie de la table orbitales périodique.
H # 1s ^ 1 #
Il # 1s ^ # 2
Li # 1s ^ 2 2s ^ # 1
Soyez # 1s ^ 2 2s ^ 2 #
B # 1s ^ 2 2s ^ 2 ^ 1 # 2 p
C # 1s ^ 2 2s ^ 2 ^ 2 # 2 p
N # 1 s ^ 2 2s ^ 2 ^ 3 # 2 p
O ^ # 1s 2 2s ^ 2 ^ 4 # 2 p
F # 1s ^ 2 2s ^ 2 ^ 5 # 2 p
Ne # 1s ^ 2 2s ^ 2 ^ 6 # 2p
Le coefficient nous indique le niveau d'énergie (rang) du tableau périodique
Le s ou p nous dire le bloc orbital.
Le superscript nous dit le nombre d'électrons dans l'orbitale.
Les groupes 1 s orbitales - 2 (colonnes) peuvent contenir 2 électrons
Les orbitales p groupes 13 - 18 (colonnes) peuvent contenir 6 électrons
Orbitales d Groupes 3-12 (colonnes) peuvent contenir des 10 électrons.
Les orbitales f peuvent contenir des 14 électrons.
Chaque niveau d'énergie doit être rempli avant de passer un niveau d'énergie.
Chaque groupe orbital doit remplir avant de passer au prochain groupe orbital.
1s
2s 2p
3s 3p
4s 3d 4p
5 s 4d 5p
6s de la 6p 5d
7s 6d de la 7p
# 1s ^ 2 2s ^ 2 ^ 6 2p 3 s ^ 2 3p ^ 6 ^ 4s 2 3d ^ 10 ^ 2 4p.
Germainum est dans la 4ème ligne niveau d'énergie du tableau périodique. L'élément est dans la deuxième colonne du bloc p, du groupe IVA (colonne 13).
Configuration électronique est un moyen de chimiste de comptabilisation de la l'adresse de tous les électrons dans un atome ou ion. La notation pour la configuration électronique est basée sur les nombres quantiques. Le nombre quantique principal est le niveau d'énergie à laquelle on trouve des électrons. Ce nombre quantique va de 1 à l'infini, mais pour les éléments connus de l'état fondamental, cette valeur n'a pas excédé n = 7 jusqu'à présent. Au sein de chaque niveau d'énergie, il y a et sous-orbitals orbitals. configurations électron indique simplement l'orbitale et ce sont s, p, d et f.
Donc, si vous regardez la configuration électronique par exemple, le soufre, qui serait écrit [S] = # 1s ^ (2) # # 2s ^ (2) # # 2 p ^ (6) # # 3 s ^ (2) # # 3p ^ (4) #. La désignation de 1, 2 et 3 sont les niveaux d'énergie. S et p sont les orbitales.
Valence électrons sont des électrons le plus niveau d'énergie extérieure. Dans le cas du soufre niveau d'énergie la plus extérieure est le niveau d'énergie le plus élevé, 3. Par conséquent, si vous regardez # 3 s ^ (2) # # 3p ^ (4) # et compter les électrons, soit un total de 6. Par conséquent, il y a 6 électrons de valence.
Pour simplifier la matière pour les éléments représentatifs, il suffit de regarder le groupe de l'élément se trouve, à savoir le nombre d'électrons de valence pour l'oxygène, le soufre et le sélénium trouvés dans la famille VIA, les électrons de valence est de 6. Pour le fluor, le chlore et le brome, trouvé dans la famille VIIA, les électrons de valence sont 7.
Lorsque l'on regarde la configuration électronique. votre commande de remplissage d'électrons est:
1s
2s 2p
3s 3p 3d
4s 4P 4d 4F
5 s
Groupe 1A (1), les métaux alcalins toute fin est s1. Quelle période l'élément est en détermine le 1er numéro.
Exemple: H se termine en 1S1 (même si H est pas un métal, il se trouve dans ce groupe car elle a aussi un électron de valence)
Li se termine dans 2s1 (lithium est dans la période 2)
Na se termine en 3S1 (sodium est dans la période 3)
éléments du groupe 2 (2A), les métaux alcalino-terreux, tous les terminaux dans s2
Groupe 3A, ou 13 toute fin de leurs configurations d'électrons en p1. Le bore se termine par 2P1.
Dans le groupe 4A ou 14, tous les éléments se terminent par p2. Et il en va.
Pour les métaux de transition, les groupes 3-12, il existe de nombreuses exceptions. La règle générale est que la configuration électronique de l'élément se termine par d et quelque endroit qu'ils se trouvent. Scandium se termine à 3d1, de titane dans 3d2, etc. Les métaux de transition sont en retard d'une période, parce que les électrons d sont riches en énergie.
Pour les éléments des terres rares (lanthanides et actinides), elles se terminent par f. Beaucoup d'exceptions ici aussi. Cérium se terminerait par 4F1, Pr à 4F2. Ces métaux des terres rares sont des 2 périodes derrière parce que les électrons f sont encore plus élevées en énergie que les électrons d.
Le « bloc de s » dans le tableau périodique sont des groupes 1 et 2; ils se terminent par s1 et s2.
Le « bloc de p » dans le tableau périodique sont des groupes 13-18 et en fin p1, etc.
Le « bloc d » sur le tableau périodique sont des groupes 3-12 forment le bloc de d et les configurations d'électrons d'éléments se terminent par d.
Le « bloc f » sur la table périodique sont les séries lanthanides et des actinides.
Bonne chance et un grand jour !!